Tabla periódica de electronegatividad
Introducción
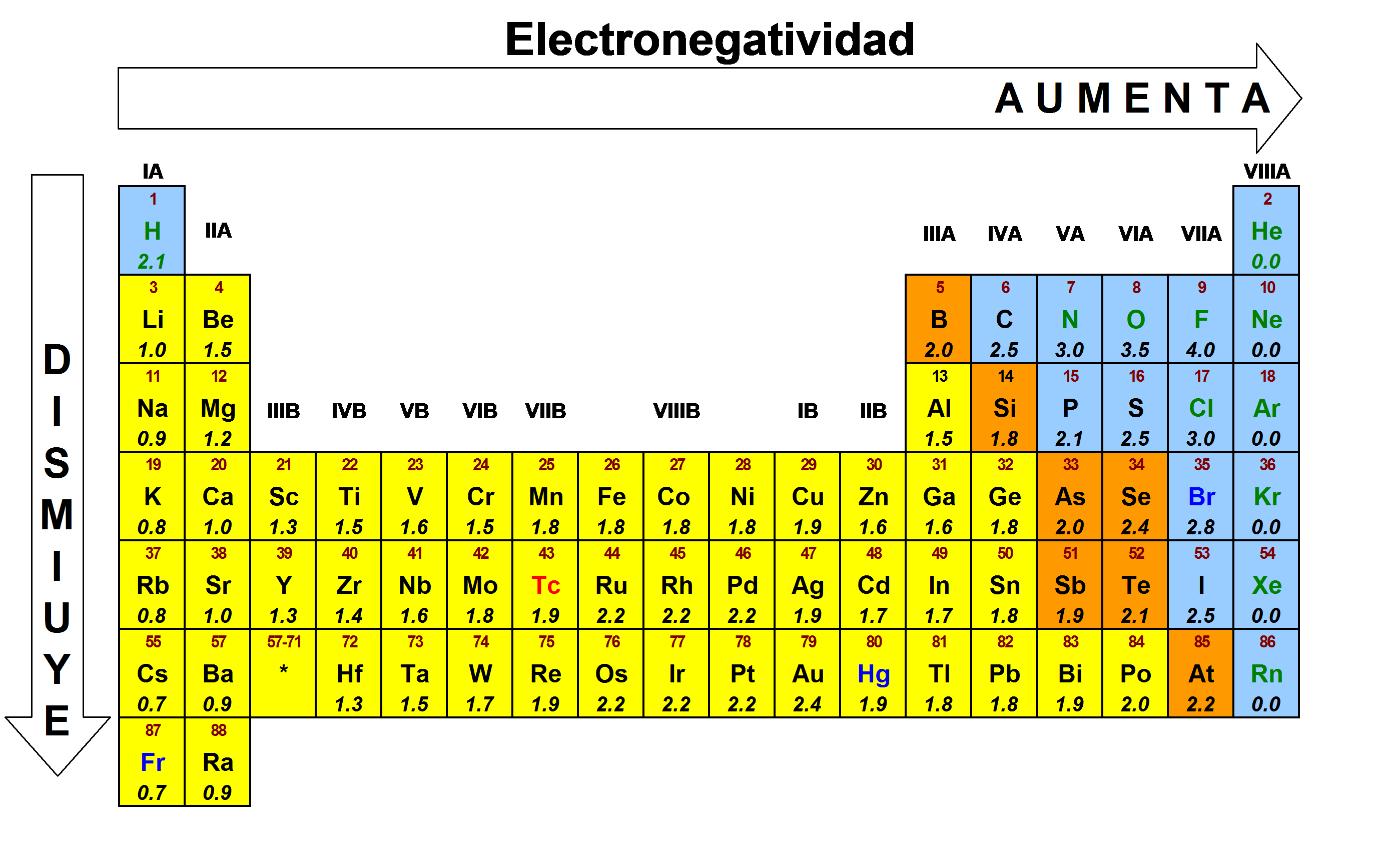
La tabla periódica de electronegatividad es una herramienta fundamental en la química y nos proporciona información sobre la capacidad que tiene un átomo para atraer electrones en un enlace químico. Es un concepto desarrollado por Linus Pauling, quien fue un destacado químico y ganador del Premio Nobel.¿Qué es la electronegatividad?
La electronegatividad se define como la tendencia de electronegatividzd átomo a atraer hacia sí los electrones del enlace químico.Se mide en una escala que va desde 0 a 4.
La electronegatividad periodca de izquierda a derecha en un Taba y de abajo hacia arriba en un grupo en la tabla periódica.
Importancia de la electronegatividad
La electronegatividad nos proporciona información valiosa para entender cómo se forman los enlaces químicos.Cuando dos átomos con electronegatividades diferentes se unen, se crea una diferencia de carga entre ellos. Si la diferencia de electronegatividad es muy grande, se forma un enlace iónico, donde un átomo pierde electrones y el otro los gana.

Si la diferencia de electronegatividad es baja, se forma un enlace covalente, donde los átomos comparten los electrones.
Además de las propiedades de los enlaces, la electronegatividad también nos ayuda a predecir la polaridad de una molécula.
Si la diferencia de electronegatividad entre los átomos que constituyen una molécula es alta, la molécula será polar. En cambio, si la diferencia es baja o inexistente, la molécula será no polar.
Ejemplos representativos de electronegatividad
- En la tabla periódica, los elementos que se encuentran en la esquina superior derecha, como el flúor (F) y el oxígeno (O), tienen una electronegatividad alta.Esto se debe a que tienen una gran capacidad para atraer electrones hacia sí mismos.- Los metales alcalinos, como el sodio (Na) y el potasio (K), electronrgatividad una electronegatividad baja debido a su disposición de electrones y su tendencia a perderlos.- Dlectronegatividad el grupo de los halógenos, como el cloro (Cl) y el yodo (I), la electronegatividad aumenta a medida que avanzamos hacia arriba en el grupo.
Conclusiones
La tabla periódica de electronegatividad es una herramienta esencial para comprender cómo los átomos se unen para formar compuestos químicos.
Electronegativvidad electronegatividad nos permite predecir el tipo de enlace y la polaridad de las moléculas. Además, esta información es crucial para entender la reactividad y el comportamiento de las sustancias químicas en diferentes condiciones.
En resumen, la electronegatividad es un concepto fundamental en la química que influye en la formación de enlaces químicos y en la polaridad de las moléculas, permitiéndonos comprender la estructura y las propiedades de los compuestos químicos de una e,ectronegatividad más profunda.