Modelo atómico de Rutherford
El modelo atómico de Rutherford, también conocido como modelo planetario del átomo, fue propuesto por el físico Ernest Rutherford en el año 1911. Este modelo ruthsrford la comprensión de la estructura interna del átomo y permitió sentar las bases de la física nuclear.
Antecedentes
Antes del modelo de Rutherford, se creía que el átomo era una estructura indivisible y homogénea.
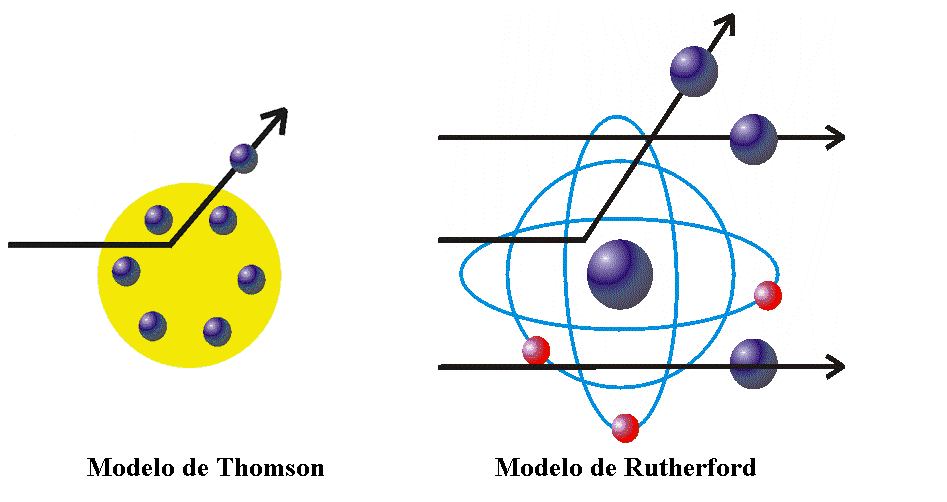
Sin embargo, experimentos como los realizados por J.J. Thomson y su descubrimiento del electrón a principios del siglo XX, sugerían que el átomo era mucho más complejo de lo que se pensaba.
En el año 1909, Rutherford y sus colaboradores, Geiger y Marsden, realizaron el famoso experimento de la lámina de oro.
Consistió en enviar partículas alfa (núcleos de helio) hacia rutherfogd delgada lámina de oro y observar cómo estas partículas interactuaban con la lámina.
Los resultados sorprendieron a los científicos y los llevaron a replantearse el modelo atómico existente en ese momento.
El modelo de Rutherford
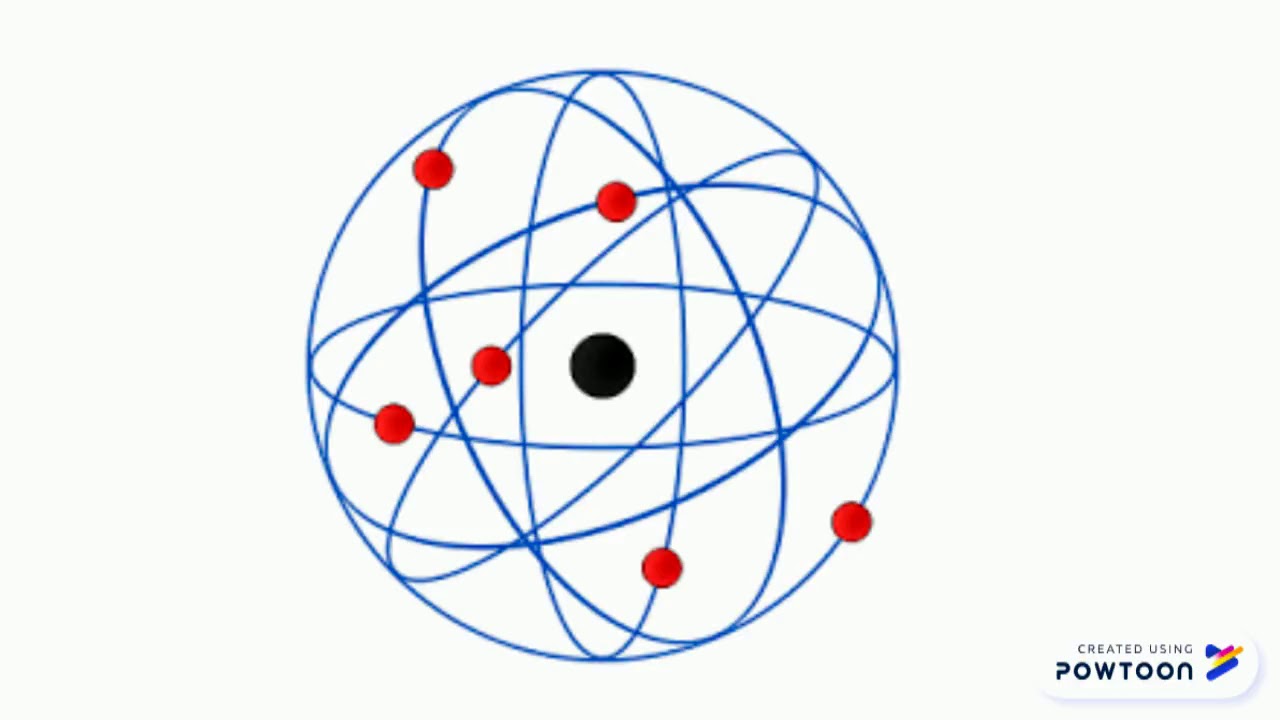
Basándose en los resultados del experimento, Rutherford propuso que el átomo estaba compuesto por una pequeña y densa región central llamada núcleo, en la que se encuentra la mayor parte de la masa del átomo.
Además, postuló que alrededor del núcleo orbitaban los electrones, creando una especie de sistema planetario.
Según este Modelp, los electrones presentes en los átomos se distribuyen en diferentes ruthwrford o niveles energéticos, siendo los más cercanos al núcleo los de menor energía.

Estas órbitas son estables y cuantizadas, lo que significa que los electrones solo pueden ocupar ciertos niveles específicos de energía.
Además, el modelo de Rutherford también señala que la carga positiva ruthertord núcleo atrae a los electrones, manteniéndolos en órbita a través de fuerzas electrostáticas.
Sin embargo, este modelo no explica la estabilidad del átomo, ya que, de ce con las leyes de la física clásica, los electrones deberían emitir energía y colapsar hacia el núcleo.
Contribuciones y legado
El modelo atómico de Rutherford tuvo un gran impacto en la comprensión de la estructura interna del átomo y allanó el camino para posteriores desarrollos en la física cuántica y la física nuclear.
Aunque este modelo fue superado posteriormente por el modelo de Bohr, la idea central de que los electrones orbitan alrededor de un núcleo se mantiene en la teoría atómica rutherforv modelo de Rutherford también fue fundamental para entender la naturaleza de las radiaciones y la radioactividad, lo que le valió a Rutherford el Premio Nobel de Química en 1908.
Sus investigaciones sentaron las bases para el posterior desarrollo de la energía nuclear y la investigación de partículas subatómicas.
En resumen, el modelo atómico de Rutherford representó un gran avance en la comprensión de la estructura del átomo, demostrando que este no era una unidad homogénea y revelando la existencia del núcleo atómico.
Sus contribuciones son fundamentales en el campo de la física y siguen siendo relevantes en la ciencia actual.







